Introduction
Le cuivre (Cu, numéro atomique 29, masse atomique 63,55 g/mol) est un oligo-élément essentiel, indispensable au bon fonctionnement cellulaire et enzymatique.
Présent à l’état de trace dans l’organisme, il agit comme cofacteur de nombreuses enzymes impliquées dans les réactions d’oxydoréduction, la respiration mitochondriale, le métabolisme du fer, la synthèse de neurotransmetteurs et de tissus conjonctifs. Son rôle biologique a été identifié dès 1928 par Hart, qui a montré qu’un régime sans cuivre provoquait une anémie chez le rat, observation ensuite confirmée par Josephs en 1931 chez un enfant présentant une dénutrition.
À la fois vital et potentiellement toxique, le cuivre illustre parfaitement la dualité de certains métaux essentiels : indispensable à faible dose, délétère lorsqu’il s’accumule.
Source
Sources naturelles
Le cuivre est présent à raison d’environ 0,0068 % dans la croûte terrestre. Les principales formes géologiques incluent la malachite, l’azurite, la chalcopyrite et divers sulfures métalliques. Il se rencontre principalement dans les roches basaltiques et schisteuses. Les granites, plus pauvres en cuivre, expliquent certaines carences géographiques observées chez l’animal (comme en Bretagne).
Sources alimentaires
Chez l’homme, la principale source d’apport est l’alimentation. Les aliments riches en cuivre sont les abats (en particulier le foie), les fruits de mers (en particulier les huitres, les moules et les coquilles Saint-Jacques), le chocolat, les champignons et les fruits secs.
Les teneurs moyennes en cuivre sont les suivantes :
- Fruits de mer : 12-37 µg/g
- Poissons : 2-3 µg/g
- Foie : 4,6-6,2 µg/g
- Noix et graines : 6-37 µg/g
- Céréales : 3-8 µg/g
- Viandes : 0,9-1 µg/g
- Légumes et fruits : 0,3-3 µg/g
L’eau potable et certains ustensiles métalliques peuvent aussi constituer des apports non négligeables.
Apports nutritionnels et recommandations
Les besoins en cuivre varient selon l’âge, le sexe et la physiologie. L’ANSES définit des apports satisfaisants journaliers (AS) et des limites supérieures de sécurité (LSS).
Apports satisfaisants journaliers (AS) en fonction du groupe de population
- Nourrissons < 6 mois : 0,3 mg/j
- Enfants 1–3 ans : 0,8 mg/j
- Enfants 7–10 ans : 1,2 mg/j
- Adolescents : 1,1–1,5 mg/j
- Adultes : hommes 1,9 mg/j, femmes 1,5 mg/j
- Femmes enceintes/allaitantes : 1,7 mg/j
https://www.anses.fr/fr/content/les-references-nutritionnelles-en-vitamines-et-mineraux
L’OMS recommande 2-3 mg/j pour l’adulte et 80-100 µg/kg/j chez le nourrisson. L’EFSA (2021) a fixé une DJA à 0,07 mg/kg/j (≈ 5 mg/j pour 70 kg).
Fonctions biologiques
Le cuivre est le troisième oligo-élément le plus abondant après le fer et le zinc. Il agit comme cofacteur de multiples cuproenzymes :
- Céruloplasmine : oxydation du Fe²⁺ en Fe³⁺ et régulation du métabolisme du fer.
- Superoxyde dismutase (SOD) : enzyme antioxydante majeure contre le stress oxydatif.
- Lysyloxydase : catalyse la réticulation du collagène et de l’élastine.
- Cytochrome-c oxydase : composant essentiel de la chaîne respiratoire mitochondriale.
- Dopamine β-hydroxylase : conversion de la dopamine en noradrénaline.
- Tyrosinase : synthèse de la mélanine.
- Histaminase : dégradation de l’histamine et régulation immunitaire.
Le cuivre joue donc un rôle central dans la respiration cellulaire, la synthèse tissulaire, la pigmentation, la neurotransmission et la protection antioxydante.
Métabolisme du cuivre
Répartition corporelle
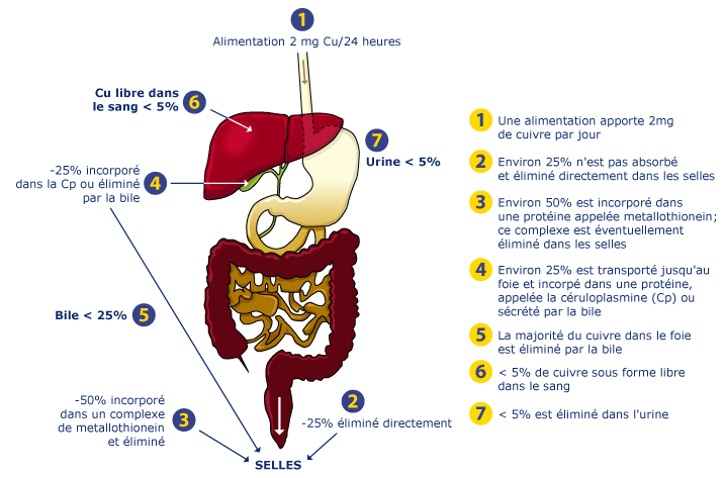
Le stock total de cuivre dans le corps humain est de 80-150 mg, principalement dans le foie, le cerveau et les reins. Le maintien de l’homéostasie dépend d’un équilibre strict entre absorption intestinale et excrétion biliaire.
Absorption intestinale
L’absorption (25-50 % chez l’adulte, 80 % chez l’enfant allaité) se produit dans l’estomac et le duodénum. Les nutriments tels que le zinc, le fer, la vitamine C ou l’alcool inhibent ce processus.
Les différentes étapes du processus d’absorption :
- Réduction du Cu²⁺ en Cu⁺ par une métalloréductase (dCytB).
- Entrée via le transporteur CTR1 (copper transporter 1) dans l’entérocyte.
- Liaison à la métallothionéine pour stockage temporaire.
- Passage vers la veine porte via ATP7A.
Au niveau hépatique
La captation hépatique est ensuite très rapide. Le cuivre est internalisé dans les hépatocytes par le transporteur CTR1. Dans l’hépatocyte, il est lié à la protéine chaperonne cytosolique Atox1 qui le transmet à la protéine ATP7B. L’ATP7B est une ATPase membranaire qui permet son transport à travers la membrane du réseau trans-Golgi et ainsi dans la voie sécrétoire de l’hépatocyte où il est incorporé à l’apo-céruloplasmine, et forme la céruloplasmine fonctionnelle (ou holo-céruloplasmine).

Transport plasmatique
En circulation, 95 % du cuivre est lié à la céruloplasmine, le reste à l’albumine, à la microglobuline ou à des acides aminés (notamment l’histidine).
Distribution tissulaire
Les organes les plus riches en cuivre sont (par ordre décroissant) : foie, cerveau, cœur et rein
Chez le fœtus, le foie concentre 60 % du cuivre total, puis la distribution devient similaire à celle de l’adulte dès 3 mois.
Élimination
L’excrétion se fait surtout par voie biliaire (25 pmol/j), contrôlée par l’ATP7B, tandis que 1-2 % du cuivre absorbé est éliminé par les urines.
Carence en cuivre
La carence est rare mais peut apparaître dans certaines conditions : prématurité, malnutrition, malabsorption (MICI, maladie cœliaque, chirurgie bariatrique), excès de zinc ou maladie génétique de Menkès (mutation ATP7A).
Conséquences cliniques :
- Baisse de la céruloplasmine ;
- Anémie hypochrome résistante au fer ;
- Ostéopénie, fractures, anomalies du collagène ;
- Hypertrophie cardiaque ;
- Retard de croissance, hypotension, troubles métaboliques (hypercholestérolémie, intolérance au glucose).
Toxicité du cuivre
Le cuivre existe sous deux états d’oxydation : Cu⁺ (intracellulaire) et Cu²⁺ (plasmatique). En excès, il induit une oxydation des lipides et protéines, la formation de radicaux libres et des lésions cellulaires.
Toxicité aiguë/chronique
- La survenue d’une toxicité aiguë est rare mais peut causer nausées, douleurs abdominales, diarrhées, atteintes hépato-rénales, anémie, voire coma et décès.
- Cirrhose infantile indienne : accumulation hépatique liée à la contamination du lait stocké dans des récipients cuivrés.
Maladies associées
– Maladie de Wilson : mutation ATP7B → défaut d’excrétion biliaire → accumulation hépatique, cérébrale, oculaire et rénale. Manifestations : anémie hémolytique, hépatite ou cirrhose, troubles neurologiques, anneau de Kayser Fleischer.
Supplémentation
La supplémentation est indiquée :
- Chez les grands prématurés ;
- Chez les patients présentant un syndrome de malabsorption.
Toute supplémentation doit être surveillée pour éviter une toxicité cumulative.
Marqueurs biologiques
L’évaluation du statut cuprique repose sur plusieurs paramètres biologiques.
Céruloplasmine
Protéine de transport du cuivre (95 % du cuivre plasmatique). Valeurs normales : 0,2–0,4 g/L. Faible à la naissance, elle augmente avec l’âge et sous l’effet des œstrogènes.
Valeurs diminuées dans : maladies de Wilson (< 0,14 g/L), de Menkès, syndrome néphrotique, insuffisance hépatique, acéruloplasminémie.
Elle augmente en cas d’inflammation.
Cuprémie, Cuivre échangeable et REC
Concentration sérique totale : 630–1660 µg/L. Diminuée dans la maladie de Wilson.
Le cuivre échangeable CuEXC (non liée à la céruloplasmine) est plus pertinent pour évaluer la toxicité et permet le suivi des patients wilsoniens traités par chélateurs.
Le ratio cuivre échangeable sur cuivre total, appelé REC (Relative Exchangeable Copper) permet le diagnostic de la maladie de Wilson avec une très bonne sensibilité et spécificité.
Cuprurie
La cuprurie des 24 h est également très utile pour le diagnostic de la maladie de Wilson : normale < 50 µg/24 h, > 100 µg/24 h en cas de surcharge. Le test à la D-pénicillamine permet de révéler les formes latentes.
Cuivre hépatique
Dosage sur foie sec : normal < 50 µg/g ; généralement > 250 µg/g dans la maladie de Wilson. La biopsie permet aussi d’évaluer la fibrose et la cirrhose.
Conclusion
Le cuivre est un oligo-élément essentiel jouant un rôle capital dans de nombreux processus biologiques. Son métabolisme repose sur des mécanismes d’absorption, de transport et d’excrétion finement régulés, principalement par les ATPases ATP7A et ATP7B.
Les déséquilibres cupriques peuvent conduire à des pathologies graves : carence (maladie de Menkès) ou surcharge (maladie de Wilson). La surveillance biologique s’appuie sur des marqueurs fiables (céruloplasmine, cuprémie, cuprurie, CuEXC, REC).
Toute intervention nutritionnelle ou thérapeutique doit tenir compte de l’équilibre délicat entre nécessité physiologique et risque toxique.
Ainsi, le cuivre illustre la complexité du rôle des métaux trace dans la santé humaine : indispensable à la vie, mais potentiellement délétère lorsqu’il échappe à la régulation.
Références
- ANSES, 2025. Références nutritionnelles en vitamines et minéraux.
- Binesh A., Venkatachalam K., 2024. Copper in human health and disease. J. Biochem. Mol. Toxicol., 38(11): e70052.
- Bost M. et al., 2016. Dietary Copper and human health. JTEMB, 35:107–115.
- EFSA, 2023. Re-evaluation of guidance values for copper. EFSA Journal 21(1):7728.
- El Balkhi S. et al., 2011. Relative Exchangeable Copper as a Biomarker for Wilson’s Disease. Clin Chim Acta 412:2254–2260.
- Lorenzen C., 2025. Relative Exchangeable Copper in Wilson Disease. Liver Int. 45(5):e70089.


